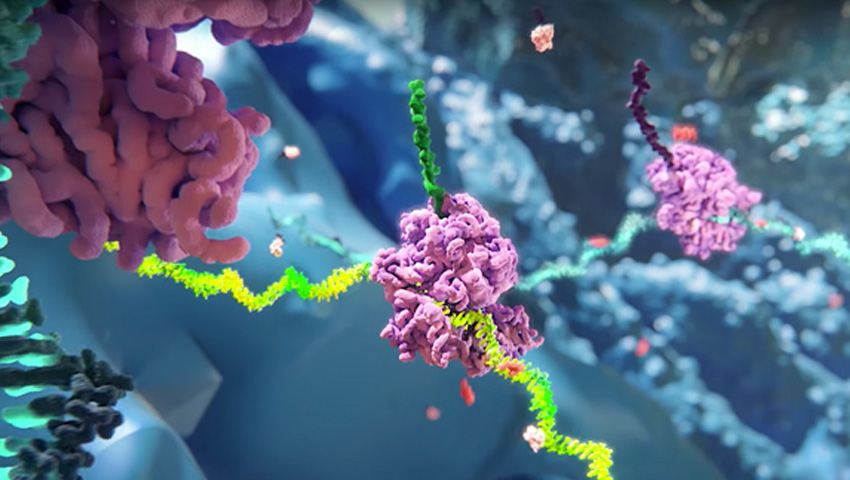
RNAi治療薬の仕組み
RNAiを用いた私たちの治療薬は、疾患の原因となる特定の遺伝子を“沈黙”させることで、タンパク質の合成を抑制します。
RNAiは、DNAの新しいタンパク質を作る命令を伝える役割を持つメッセンジャーRNA(mRNA)に “干渉” することによって、遺伝 ⼦発現(タンパク質の合成)を制御する生物にもともと備わっている自然なプロセスです。当社のRNAi治療薬は、このプロセスを再現し、特別に設 計された低分⼦⼲渉RNA(small interfering RNA: siRNA)を送達することで、RNA誘導サイレンシング複合体(RISC: RNA-induced silencing complex)の⼀部として、疾患の原因となる特定のmRNAに結合し、ハサミのようにその分解を誘導し、疾患の原因と なるタンパク質の産⽣を抑制します。
遺伝学的に検証された標的に作⽤することで、当社のRNAi治療薬は、低分⼦化合物やモノクローナル抗体など、他の多く の医薬品よりも “上流” で作⽤します.
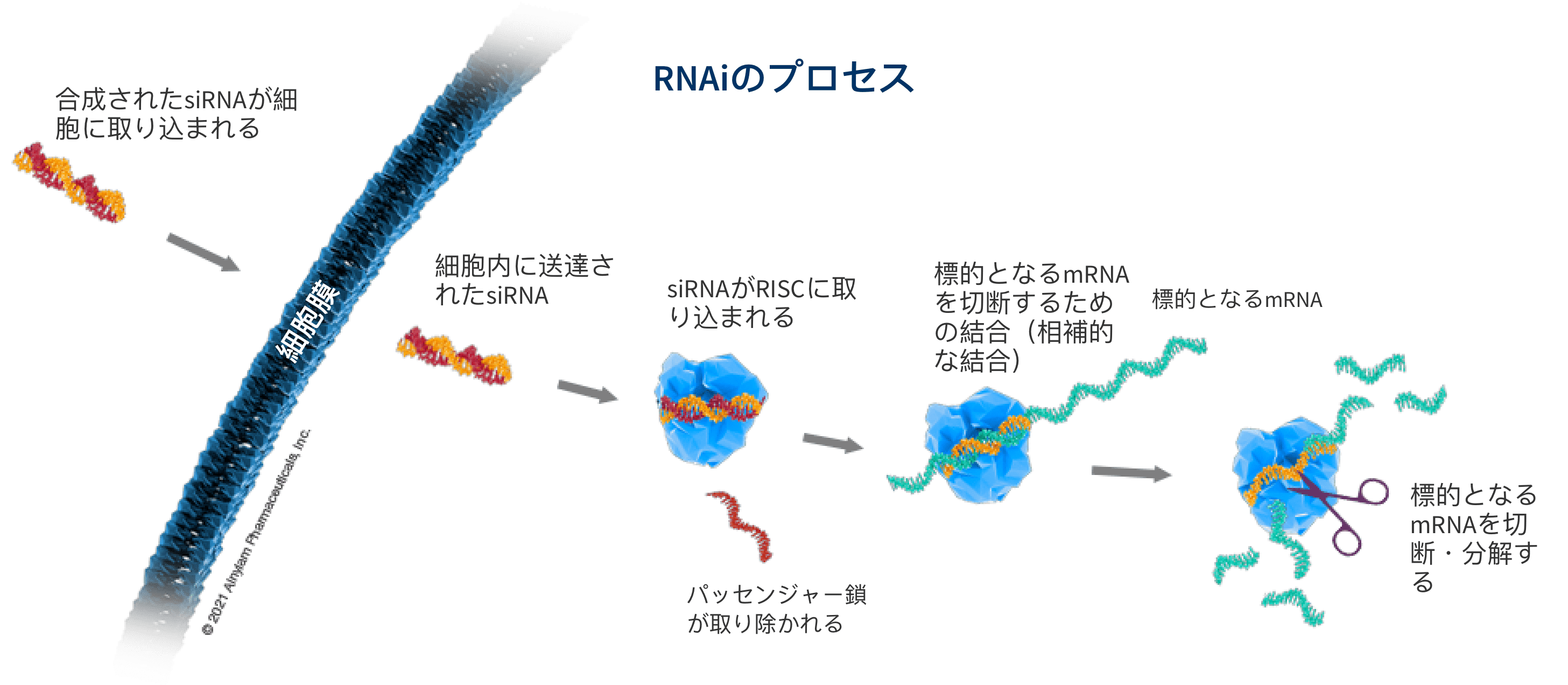
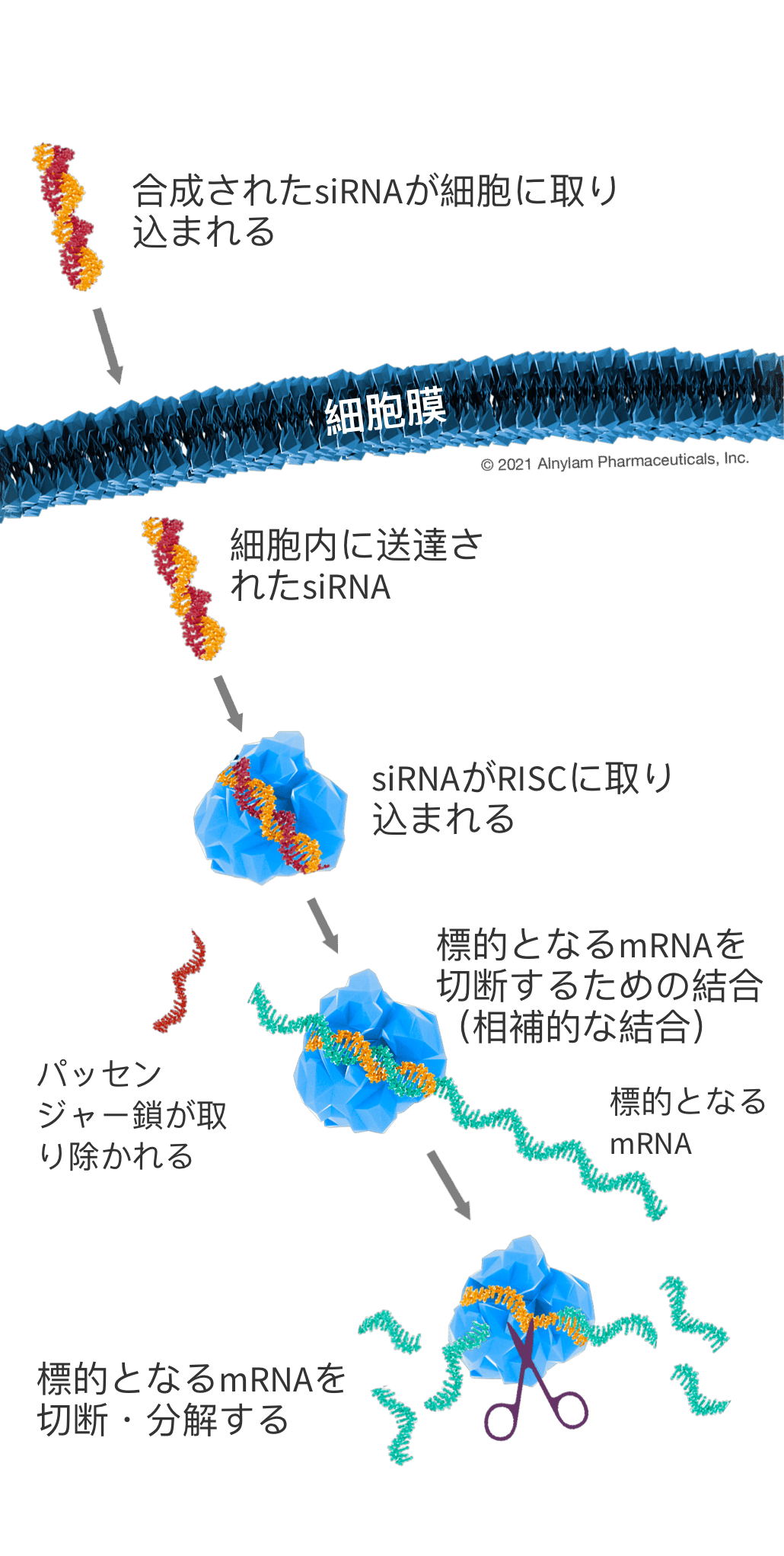
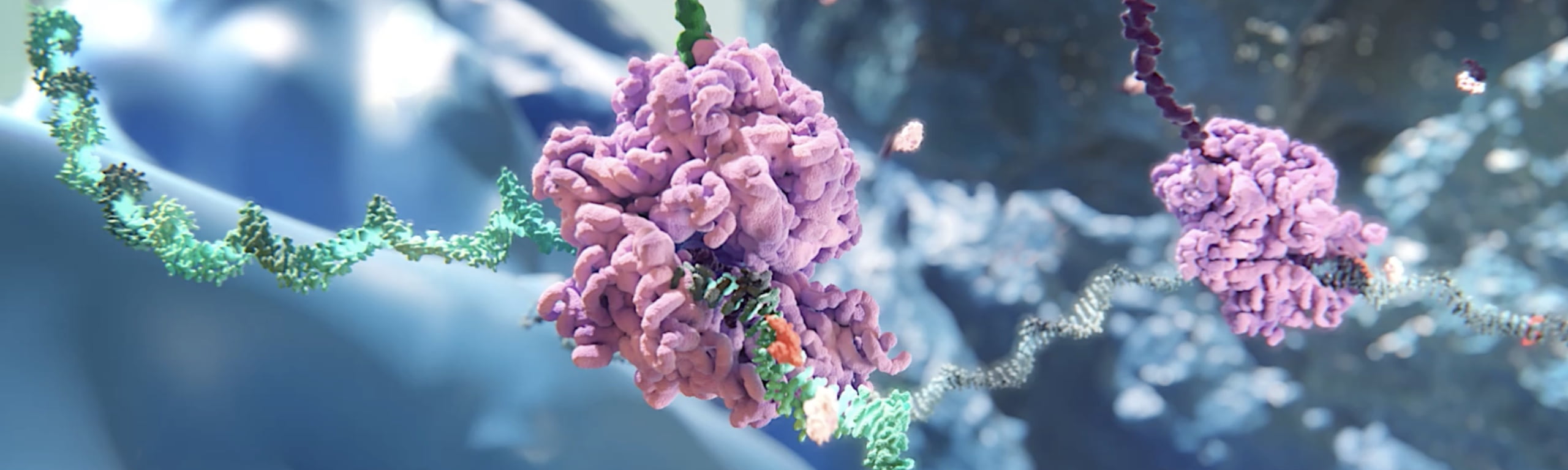
siRNAの仕組み
⼆本鎖siRNAが細胞に送達されると、RNAi経路の主要な構成要素として細胞内に存在するRNA誘導サイレンシング複合体(RISC)と 呼ばれるタンパク質複合体がそれを認識します。RISCに認識されたsiRNAは、⼆本鎖のうちの1つ(パッセンジャー鎖)が取り除 かれます。残されたもう1つの鎖(ガイド鎖)はRISCと結合し、さらに相補的mRNAと結合するのを誘導し、リボソームによってタンパク質に変換される前に、ハサミのように、 “不要” な標的mRNAを切断し、分解させます。このプロセスは 触媒的であり、つまり1本のsiRNAを取り込んだRISCが、多くの標的mRNAを繰り返し分解することができます。それにより、 “不要” なタンパク質の⽣成が減少・抑制されます。
さらに、RNAウイルスやその宿主因⼦を直接標的として破壊し、ウイルスの複製を阻⽌したり、細胞内に侵⼊できないようにし たりするなど、感染症に対応するsiRNAの開発も可能であると考えています。
私たちのRNAi治療薬の主な特徴
- 理論上、低分⼦化合物や抗体では「治療不可能な(undruggable)」標的を含め、ゲノム上のあらゆる遺 伝⼦を標的とすることが可能
- ⾼い有効性と持続的な効果(年2回または年1回という投与頻度の少なさ)を持つ
- 静脈内投与、⽪下投与、吸⼊投与など複数の投与⽅法ができる
- 遺伝⼦を抑制する他のアプローチと⽐較して、低⽤量・低投与頻度でも臨床的有⽤性が実証されており、全体的な安全性も期待できる
- モジュール化されており、再現性が⾼く、どの臓器や疾患においても⼀貫した性能を発揮する